Efficiency of ozone micro nano bubbles in treating concentrated brine in zero discharge process of coking wastewater
-
摘要:
焦化废水的零排放工艺中使用蒸汽机械再压缩(MVR)蒸发结晶处理膜浓缩液,最终产生超高盐浓缩液废水,其难以通过传统氧化方法进行处理。臭氧微纳米气泡技术能够提高臭氧传质效率、增强臭氧氧化能力,可望用于处理MVR浓缩母液。为验证该技术的工程应用可行性,以MVR浓缩母液为研究对象,对比臭氧微纳米气泡和普通大气泡2种曝气方式下臭氧传质速率以及有机物的降解效能,从技术、经济角度分析盐浓度和有机物浓度对2种臭氧氧化工艺处理效果的影响,以界定臭氧微纳米气泡技术处理高盐废水的适用范围。结果表明:随着盐浓度从0.1 mol/L增加至1 mol/L,微纳米气泡和普通大气泡的臭氧传质系数分别提高0.13和0.09倍,臭氧自分解速率分别升高2.10和1.38倍。在处理高盐、高有机物废水(TOC浓度为57.2~587.6 mg/L,电导率为3.47~28.6 mS/cm)时,臭氧微纳米气泡较普通大气泡的TOC去除率提升0.50~3.76倍,吨水能耗最大可降低71%;处理超高盐、超高有机物废水(TOC浓度为5 626 mg/L,电导率为164.3 mS/cm)时,臭氧微纳米气泡去除效果与普通大气泡趋于一致且吨水能耗更高。高盐废水的盐浓度和有机物浓度对臭氧微纳米气泡处理效能影响显著,工程应用中应根据废水特性选择合适的臭氧曝气方式。
Abstract:In the Zero Liquid Discharge (ZLD) process of coking wastewater, mechanical vapor recompression (MVR) evaporation crystallization is employed to treat membrane-concentrated liquor, ultimately yielding highly saline concentrated wastewater, which is challenging to treat using conventional oxidation methods. Ozone micro nano bubble technology can enhance ozone mass transfer efficiency and augment its oxidation capability, making it a promising method for treating MVR-concentrated discharge. To verify the feasibility of engineering applications of this technology, this study focused on MVR-concentrated discharge and compared the ozone mass transfer rate and organic degradation efficiency between ozone micro nano bubbles and conventional macrobubbles. It analyzed the impact of salinity and organic concentration on the treatment efficiency of both ozone oxidation processes from technical and economic perspectives, thereby delineating the applicable scope of ozone micro nano bubble technology for high-salinity wastewater treatment. The results indicated that as the salinity increased from 0.1 mol/L to 1 mol/L, the ozone mass transfer coefficients for ozone micro nano bubbles and conventional macrobubbles increased by 0.13 and 0.09 times, respectively, with the ozone self-decomposition rate rising by 2.10 and 1.38 times, respectively. When treating high-salinity and high-organic wastewater (TOC 57.2-587.6 mg/L, conductivity 3.47-28.6 mS/cm), ozone micro nano bubble technology could enhance TOC removal rates by 0.50 to 3.76 times compared to conventional macrobubble technology, while reducing energy consumption per ton of water by up to 71%. When treating ultra-high salinity and ultra-high organic wastewater (TOC 5 626 mg/L, conductivity 164.3 mS/cm), the removal efficiency of micro nano bubbles tended to align with that of conventional macrobubbles, albeit with higher energy consumption per ton of water. The salinity and organic concentration of high-salinity wastewater significantly affect the treatment efficiency of ozone micro nano bubbles, and the appropriate ozone aeration method should be selected based on the wastewater characteristics in engineering applications
-
随着我国国民经济的稳步增长,钢铁产业的迅猛发展导致钢铁产量显著提升。焦炉操作是钢铁生产中必不可少的一个环节,但其同时伴随着大量焦化废水的生成[1],这种废水因含有高浓度的有毒有害物质和难以降解的污染物而成为环境治理的难题[2]。随着焦化废水“零排放”要求的提出,其处理过程中产生的膜浓缩浓盐水日益受到关注[3]。为了满足其排放的环保要求,目前采用蒸汽机械再压缩(mechanical vapor recompression,MVR)工艺对焦化废水中的浓盐水进行处理。然而该过程中会产生含高浓度有机物的超高盐浓缩液废水,一般称之为MVR浓缩母液,其COD高达10 000 mg/L,电导率高达150 mS/cm,高度浓缩态的废水受有机物的影响不能再持续蒸发[4]。因此亟需研究有效的处理方法以确保其污染物浓度达到或低于相关排放标准。
在众多废水处理技术中,臭氧氧化技术以其强氧化能力、不产生化学污泥和无二次污染的特点而备受关注[5-6],有望用于处理MVR浓缩母液。然而,由于MVR浓缩母液中盐分和有机物浓度极高,对臭氧传质过程提出了更高的要求。而普通大气泡曝气技术的利用率低、系统不稳定,高盐、高悬浮物会导致曝气盘堵塞,设施无法正常运转,而采用臭氧催化氧化时会出现固体催化剂易板结、失活快等问题。相比之下,微纳米气泡(MNBs)技术因其微小的气泡直径(小于100 μm)、较长的停留时间、较大的比表面积、较高的传质效率及产生羟基自由基等特点,更适合高效产生臭氧并促进氧化过程[7-9]。将臭氧与微纳米气泡联用,能够提高臭氧传质效率、增强臭氧氧化能力,有效去除难降解有机物[10-13]。将臭氧微纳米气泡应用于生化出水(COD≤200 mg/L,电导率≤10 mS/cm)处理中,臭氧投加量为200 mg/L时,COD的去除率为33%~58%[14-15];应用于反渗透(RO)浓水(COD为200~2 000 mg/L,电导率为10~40 mS/cm)的处理中,臭氧投加量为400 mg/L时,COD的去除率为44%~61%[16-17]。可见臭氧微纳米气泡技术能高效处理有机废水,可望用于处理MVR浓缩母液。因此,笔者以焦化废水处理过程中的MVR浓缩母液为研究对象,深入探究不同盐离子和有机物浓度对臭氧微纳米气泡处理效率的影响,进一步界定臭氧微纳米气泡技术的最优应用范围,以期为高盐废水的高效处理提供科学依据和技术参考。
1. 材料和方法
1.1 试验材料
高盐MVR浓缩母液来自马鞍山某钢铁公司处理焦化废水的零排放工艺,命名为1#原废水。将其稀释不同倍数得到4种盐浓度及有机物浓度的废水,分别命名为2#、3#、4#废水,具体水质指标如表1所示。
表 1 待处理废水的主要成分和指标Table 1. Main components and indexes of wastewater to be treated废水 稀释倍数 电导率/(mS/cm) pH COD/(mg/L) 总有机碳(TOC)/(mg/L) ${\mathrm{SO}}_4^{2-} $/(mg/L) Cl−/(mg/L) UV254 1#原废水 不稀释 164.30 9.34 11 100 5 626.0 149 220 74 310 0.870 2#废水 10倍 28.60 8.72 1 140 587.6 14 720 7 350 1.038 3#废水 50倍 6.44 7.45 253 117.7 2 941 1 437 1.030 4#废水 100倍 3.47 7.16 123 57.2 1 460 726 1.070 注:UV254为稀释后的测定值,1#原废水稀释100倍,2#废水稀释10倍,3#废水稀释2倍,4#废水不稀释。 1.2 试验装置及方法
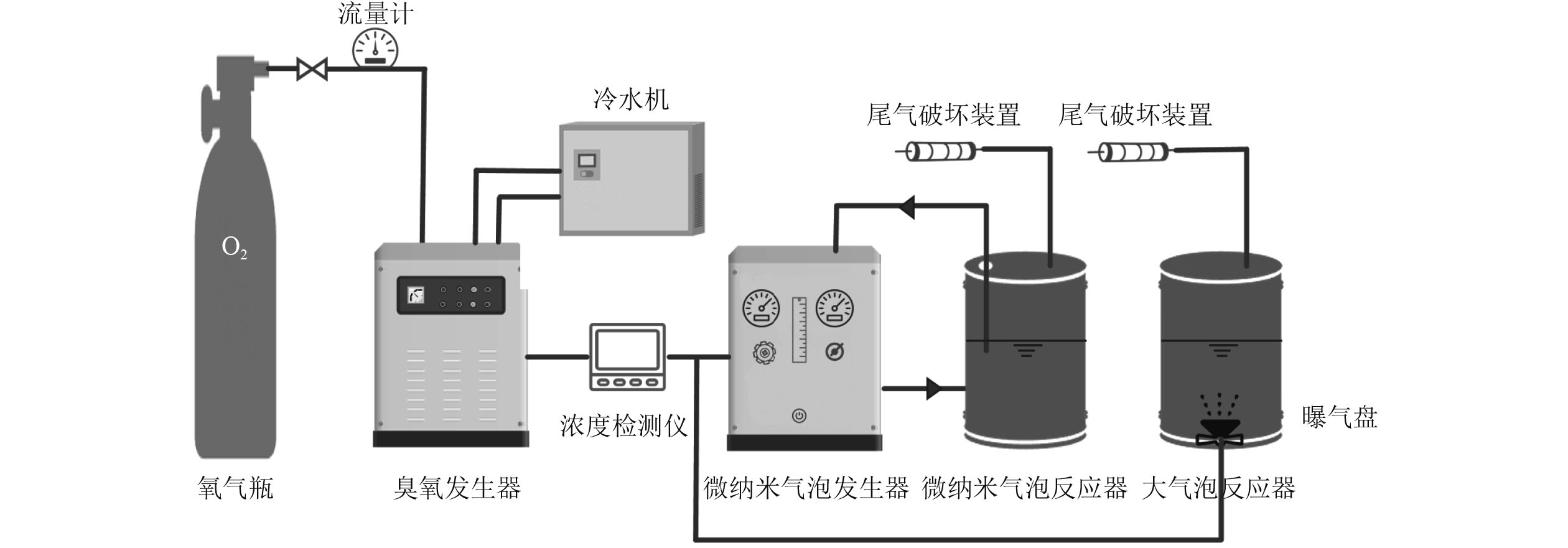
试验设置微纳米气泡曝气和普通大气泡曝气2种曝气方式,在半连续流臭氧氧化试验装置中进行。臭氧微纳米气泡氧化装置主要由臭氧发生器(OzonMini-200-50,天祺超氧)、微纳米气泡发生器(OXYDEEP-TABLE-0.3,天祺超氧)和反应器3部分组成,臭氧大气泡氧化装置主要由臭氧发生器和装配曝气盘的反应器2部分组成,如图1所示。
微纳米气泡反应器为直径200 mm、高600 mm的圆柱体,材质为有机玻璃。普通大气泡反应器的尺寸和材质与微纳米气泡反应器相同,在其底部安装了1个直径为100 mm的圆形钛板进行曝气。通过预试验发现,微纳米气泡在水中基本不上浮,水深对其臭氧传质基本没有影响。但普通大气泡曝气的臭氧传质受水深影响较大,因此本试验选用柱状反应器以提高液位高度,增加大气泡的停留时间,同时也更符合工程应用现状。
臭氧氧化试验方法如下:每次试验分别在反应器中加入4 L待处理的1#原废水、2#废水、3#废水、4#废水。打开氧气瓶,氧气通过流量计进入臭氧发生器产生臭氧,调节气体流量至0.3 L/min使臭氧浓度达到150 mg/L。待臭氧气体浓度稳定后,启动微纳米气泡发生器,通过加压溶气—减压释放法产生臭氧微纳米气泡,通入反应器与废水中的有机物发生氧化反应,同时打开臭氧尾气处理装置。
1.3 试验设计及测定方法
1.3.1 微纳米气泡表征
配制0.1 和1 mol/L NaCl溶液各4 L,利用微纳米气泡发生器在溶液中引入微纳米气泡,分别测定微米气泡和纳米气泡的粒径分布。采用气泡图像及颗粒度原位在线实时检测仪(Pixact,PBM)测定微米气泡以表面积为基准的粒径分布,采用纳米颗粒跟踪仪(Particle-metrix,Zetaview)测定纳米气泡以个数为基准的粒径分布。
1.3.2 臭氧传质系数测定
臭氧传质系数通过测定臭氧曝气过程中反应器内溶解的臭氧浓度变化获得,分别在0.1和1 mol/L NaCl溶液中通入臭氧微纳米气泡或臭氧大气泡进行曝气,定时取样并采用靛蓝法[18-19]测定每个水样的液相臭氧浓度。试验水温为(15±2)℃,pH为7,试验时间为60 min,0~15 min为臭氧曝气过程,15 min时结束曝气并开始臭氧自分解过程。臭氧传质系数的具体计算方法见式(1)~式(4)。
半连续流试验中臭氧质量平衡遵循下式:
$$ \frac{\mathrm{d}C}{\mathrm{d}t}={k}_{\mathrm{L}}a\left({C}^{*}-C\right)-r $$ (1) 式中:C为液相臭氧浓度,mg/L;t为反应时间,min;kL为液膜传质分系数,m/min;a为气液比表面积,m−1;C*为气液界面的臭氧平衡浓度,mg/L;r为臭氧自分解速率,mg/(L·min)。kLa用来表示体积传质系数,min−1。
在水中臭氧会发生自分解反应,臭氧自分解基本符合一级动力学[20],可用下式表示:
$$ r=-\frac{\mathrm{d}C}{\mathrm{d}t}={k}_{\mathrm{d}}C $$ (2) 式中kd为臭氧自分解反应的一级动力学系数,min−1。
在15 min停止臭氧曝气后,通过检测臭氧浓度随时间的变化可以计算kd[21]。当达到平衡状态时,液相臭氧浓度不随时间发生变化,式(1)中$ \dfrac{\mathrm{d}C}{\mathrm{d}t}=0 $,C = Cs,将式(2)中的r代入式(1),可得:
$$ 0=k_{\mathrm{L}}a\left(C^*-C_{\mathrm{s}}\right)-k\mathrm{_d}C_{\mathrm{s}} $$ (3) 式中Cs为饱和液相臭氧浓度,mg/L。
由式(3)可得$ {C}^{*}=\dfrac{{k}_{\mathrm{d}}{+k}_{\mathrm{L}}a}{{k}_{\mathrm{L}}a}{C}_{\mathrm{s}} $,将C*代入式(1)并积分,可得:
$$ \mathrm{ln}\frac{{C}_{\mathrm{s}}}{{C}_{\mathrm{s}}-C}=(k_{\mathrm{L}}a+{k}_{\mathrm{d}})t $$ (4) 根据半连续流试验中测得的液相臭氧浓度获得ln[Cs/(Cs-C)]随时间变化的线性拟合曲线,根据式(4)二者关系呈线性,直线的斜率即为(kLa+kd),其减去自分解过程中得到的kd,即得出kLa的值。
1.3.3 臭氧微纳米气泡和普通大气泡处理MVR母液试验
取4 L的MVR浓缩母液及稀释不同倍率的废水于反应器中,分别采用臭氧微纳米气泡和普通大气泡曝气,设置臭氧速率为45 mg/min。1#原废水的反应时间为300 min,反应过程中每30 min取1次样;2#废水的反应时间为120 min,反应过程中每20 min取1次样;3#废水的反应时间为60 min,反应过程中每10 min取1次样;4#废水的反应时间为30 min,反应过程中每5 min取1次样。依次测定水样的总有机碳(TOC)、COD、UV254,按下式计算臭氧投加量与COD去除量之比(O/C)和臭氧投加量与TOC去除量之比(O/T):
$$ \mathrm{O/C}=\mathrm{\mathit{C}_{O_3}}/\Delta\mathrm{COD} $$ (5) $$ \mathrm{O/T}=\mathrm{\mathit{C}_{O_3}}/\Delta\mathrm{TOC} $$ (6) 式中:${\mathit{C}_{{\mathrm{O}}_3}} $表示试验中臭氧的投加量,为试验前后累计的臭氧投加量之和,mg/L;$ \Delta $COD表示试验中去除的化学需氧量,为处理前后废水的COD差,mg/L;$ \Delta $TOC表示试验中去除的总有机碳量,为处理前后废水中TOC浓度差,mg/L。
1.3.4 臭氧处理过程中有机物表征
选取2#废水,以其处理前、微纳米气泡处理120 min、普通大气泡处理120 min这3种状态作为研究对象,进行三维荧光及紫外-可见吸收光谱分析。三维荧光采用荧光分光光度计(Shimadzu,RF-6000)测定,激发波长(Ex)为220~450 nm,发射波长(Em)为280~550 nm,根据波长及所对应的分子属性将荧光相应区域分为Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ 5个荧光区域并对其进行区域积分(FRI)。紫外-可见吸收光谱采用紫外-可见分光光度计(Hach,DR3900)测定,测定波长范围为220~500 nm。
1.4 检测方法
臭氧发生器出口的气相臭氧浓度采用气相臭氧浓度测定仪(USIDEAL,UVOZ-3300C)测定;废水的UV254采用紫外-可见分光光度计(Hach,DR3900)测定,废水中COD的测定参照HJ/T 399—2007《水质 化学需氧量的测定 快速消解分光光度法》[22];废水中TOC采用总有机碳分析仪(Shimadzu,TOC-L CPH)测定,Cl−及${\mathrm{SO}}_4^{2-} $浓度采用离子色谱仪(Shimadzu,LC-20ADSP)测定。
2. 结果与讨论
2.1 高盐条件下微纳米气泡特性及臭氧传质系数
在臭氧氧化有机物的过程中,臭氧的传质速率是一个关键因素,气泡的尺寸对传质速率具有显著影响。已有研究表明,盐浓度会影响气泡的大小及其传质特性[23]。因此,有必要在高盐条件下测定微纳米气泡的尺寸,并研究盐浓度对臭氧传质速率的影响。
2.1.1 高盐条件下微纳米气泡表征
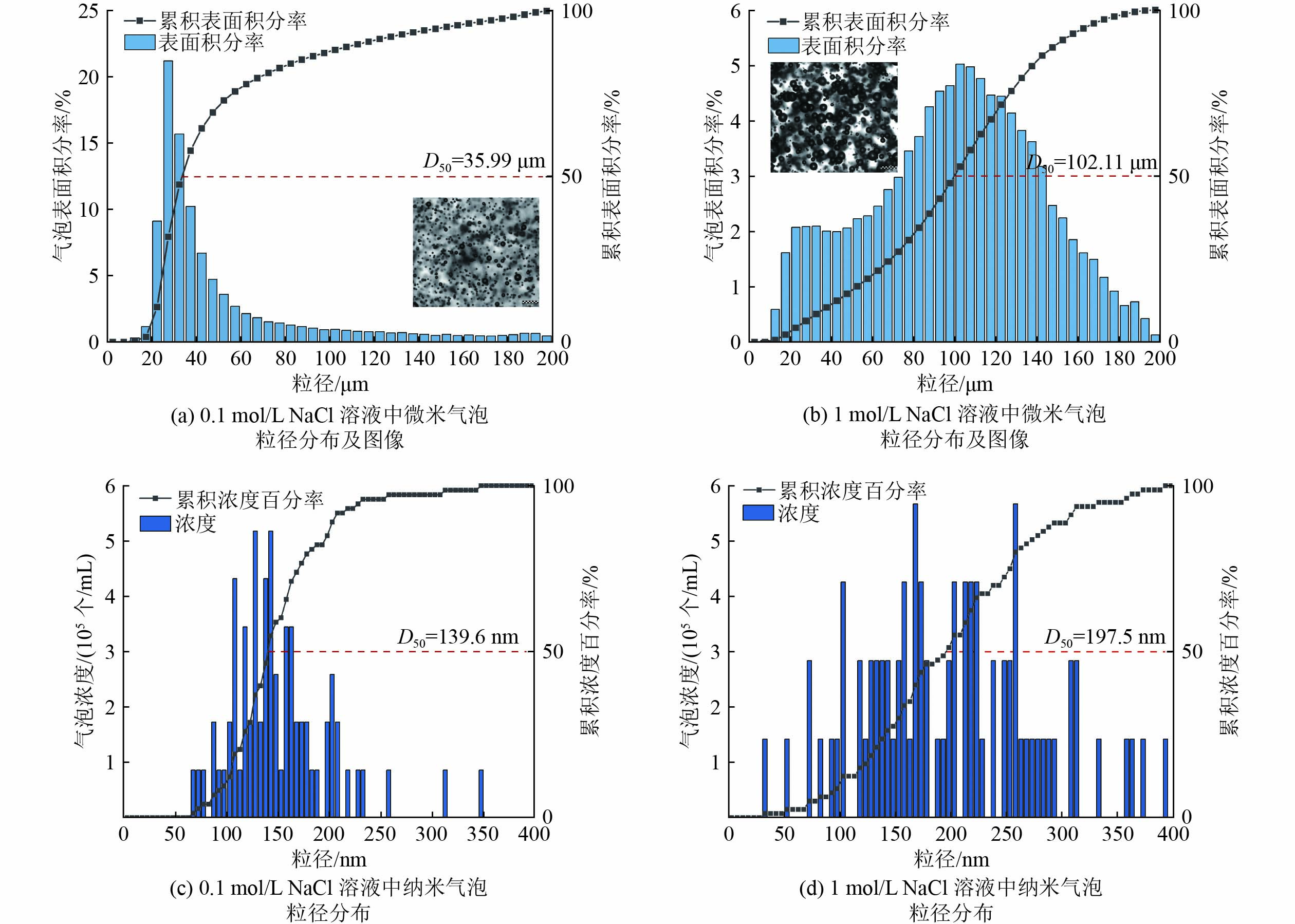
分别在0.1和1 mol/L NaCl溶液中生成微纳米气泡,同时测定微米气泡和纳米气泡的尺寸,考察盐浓度对微纳米气泡尺寸分布的影响,结果见图2。
由图2(a)和(b)可知,0.1 mol/L NaCl溶液中微米气泡粒径的中位径(D50)为35.99 μm,而1 mol/L NaCl溶液中D50为102.11 μm,气泡的直径在高盐条件下显著增加。在0.1 mol/L NaCl溶液中,微米气泡的直径主要集中在20~60 μm,而在1 mol/L NaCl溶液中,气泡直径呈现出较为均匀的分布,范围扩展至20~160 μm。
由图2(c)和(d)可知,纳米气泡与微米气泡变化趋势类似,纳米气泡在0.1 mol/L NaCl溶液中粒径的D50为139.6 nm,而在1 mol/L NaCl溶液中增至197.5 nm。由此可见,微纳米气泡在高盐条件下倾向于生成更大的气泡,气泡尺寸增加。然而,普通大气泡曝气往往随着盐浓度增加,产生的气泡尺寸逐渐降低,这与微纳米气泡的趋势相反[23]。微纳米气泡和普通大气泡在不同盐浓度条件下呈现相反的气泡尺寸变化规律,这将会影响臭氧传质速率,进而影响臭氧氧化降解有机物的速率。
2.1.2 盐浓度对臭氧传质系数的影响
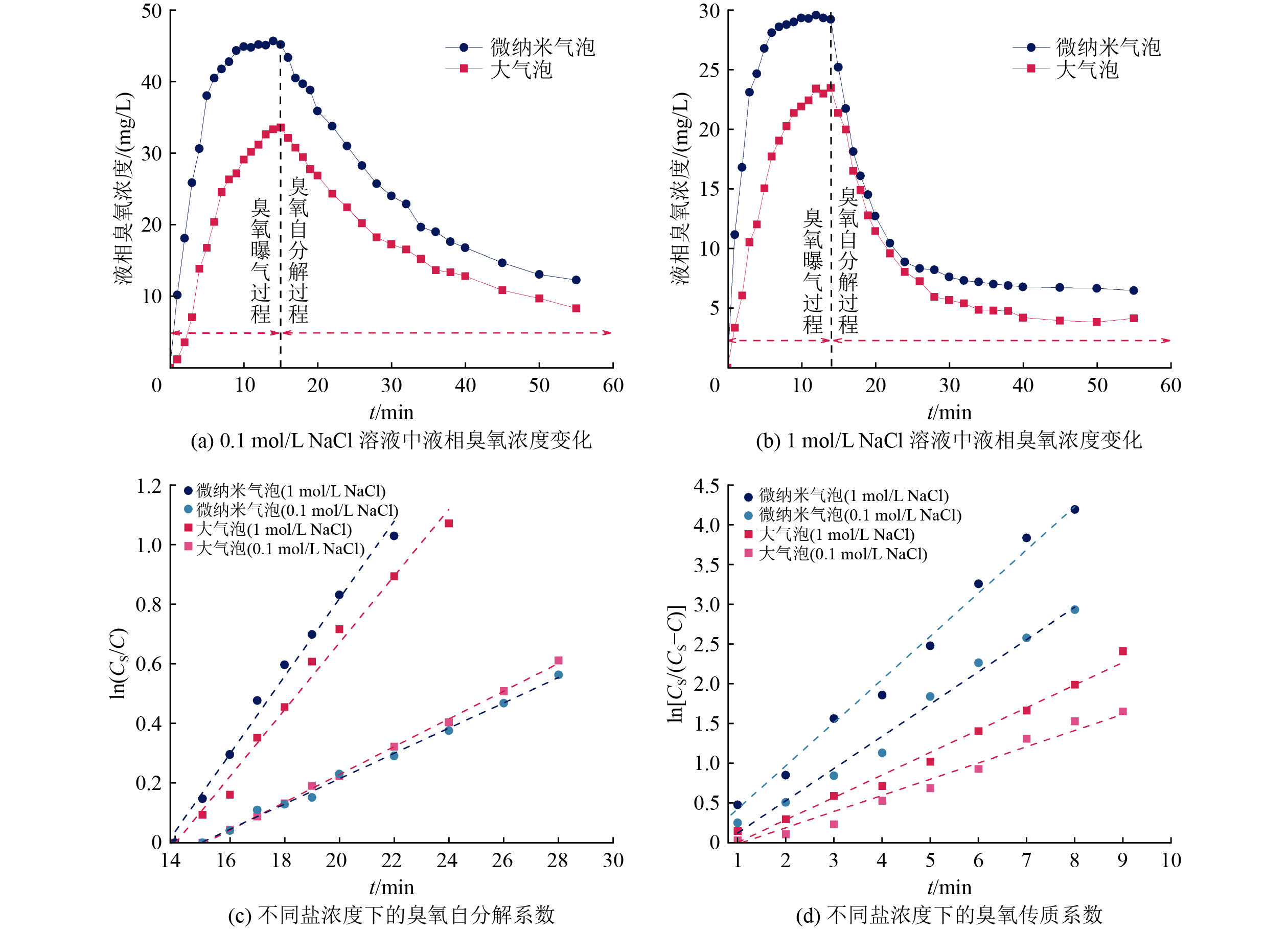
不同盐浓度下的液相臭氧浓度变化及臭氧传质系数计算过程的线性拟合曲线如图3所示。根据1.3.2节的计算方法,通过ln[Cs/(Cs−C)]随时间变化的趋势图得出kLa,结果见表2。
表 2 盐浓度对不同臭氧曝气方式的气泡尺寸和传质参数的影响Table 2. Impact of salt concentration on bubble size and mass transfer parameters by various ozone aeration methodsNaCl浓度/
(mol/L)曝气方式 D50 Cs/
(mg/L)kLa/min−1 kd/min−1 微米
气泡/μm纳米
气泡/nm0.1 大气泡 33.60 0.157 0.047 微纳米气泡 35.99 139.60 45.18 0.364 0.042 1 大气泡 23.46 0.171 0.112 微纳米气泡 102.11 197.50 29.20 0.413 0.130 由图3(a)和(b)及表2可知,在0.1 mol/L NaCl溶液中,臭氧微纳米气泡、普通大气泡曝气的Cs分别为45.18与33.60 mg/L,臭氧微纳米气泡曝气的Cs是普通大气泡曝气的1.34倍;随着NaCl浓度升高至1 mol/L时,二者的Cs均有所降低,分别为29.20、23.46 mg/L,臭氧微纳米气泡曝气的Cs是普通大气泡曝气的1.24倍。此外,曝气15 min结束后,液相臭氧浓度由于臭氧的自分解开始逐渐降低,且随着盐浓度从0.1 mol/L增加到1 mol/L,其由缓慢下降变化至急剧下降,这是由于Cl−和臭氧发生直接反应[24],从而加快臭氧自分解速率,使得饱和液相臭氧浓度下降。
如图3(c)和(d)所示,ln(Cs/C)与t、ln[Cs/(Cs−C)]与t均符合线性关系,根据式(2)和式(4)拟合直线斜率分别为kd和kLa+kd。同时由表2可知,在0.1 mol/L NaCl溶液中,微纳米气泡的kLa和kd分别为0.364和0.042 min−1,是普通大气泡的2.32和0.89倍(kLa为0.157 min−1,kd为0.047 min−1)。而在1 mol/L NaCl溶液中,微纳米气泡的kLa和kd分别为0.413和0.130 min−1,是普通大气泡的2.42倍和1.16倍(kLa为0.171 min−1,kd为0.112 min−1)。随着盐浓度从0.1 mol/L增加至1 mol/L,微纳米气泡和普通大气泡的kLa分别提高0.13和0.09倍,kd分别升高2.10和1.38倍。这说明随着盐浓度升高,微纳米气泡曝气和普通大气泡曝气的臭氧传质系数与臭氧自分解速率均增加。水中的Cl−和臭氧以及·OH发生反应,促使臭氧自分解速率增加,主要反应为[25-26]:
$$ \mathrm{O}_3+\mathrm{C}\mathrm{l}^-\to\mathrm{C}\mathrm{l}\mathrm{O}^-+\mathrm{O}_2\quad k_1=2.2\times10^{-3}\, \mathrm{L}/\left(\mathrm{mol^{ }}\cdot\mathrm{s}^{ }\right) $$ (7) $$ \mathrm{C}\mathrm{l}^-+\cdot\mathrm{O}\mathrm{H}\to\mathrm{C}\mathrm{l}\mathrm{O}\mathrm{H}\cdot^-\quad k_2=4.3\times10^9\; \mathrm{L}/\left(\mathrm{mol}\cdot\mathrm{s}^{ }\right) $$ (8) $$ \mathrm{C}\mathrm{l}\mathrm{O}\mathrm{H}\cdot^-\to\mathrm{C}\mathrm{l}^-+\cdot\mathrm{O}\mathrm{H}\quad k_3=6.1\times10^9\; \mathrm{L}/\left(\mathrm{mol}\cdot\mathrm{s}\right) $$ (9) 在低盐条件下,臭氧微纳米气泡的自分解速率低于臭氧大气泡,而在1 mol/L NaCl的高盐条件下臭氧微纳米气泡的自分解速率更快,说明盐浓度对微纳米气泡曝气的臭氧自分解速率影响更大。
由2.1.1节可知,盐浓度的增加导致微纳米气泡粒径增大,kLa中比表面积a的降低可能会导致传质速率下降。但是由表2可知,高盐条件下臭氧微纳米气泡传质速率实际上出现了上升。这是由于臭氧微纳米气泡自分解速率的升高加速了臭氧从气相向液相的传质过程,从而抵消了微纳米气泡粒径增大给传质所带来的负面影响。
2.2 臭氧微纳米气泡和普通大气泡处理MVR母液的效果
2.2.1 TOC与UV254的去除效果
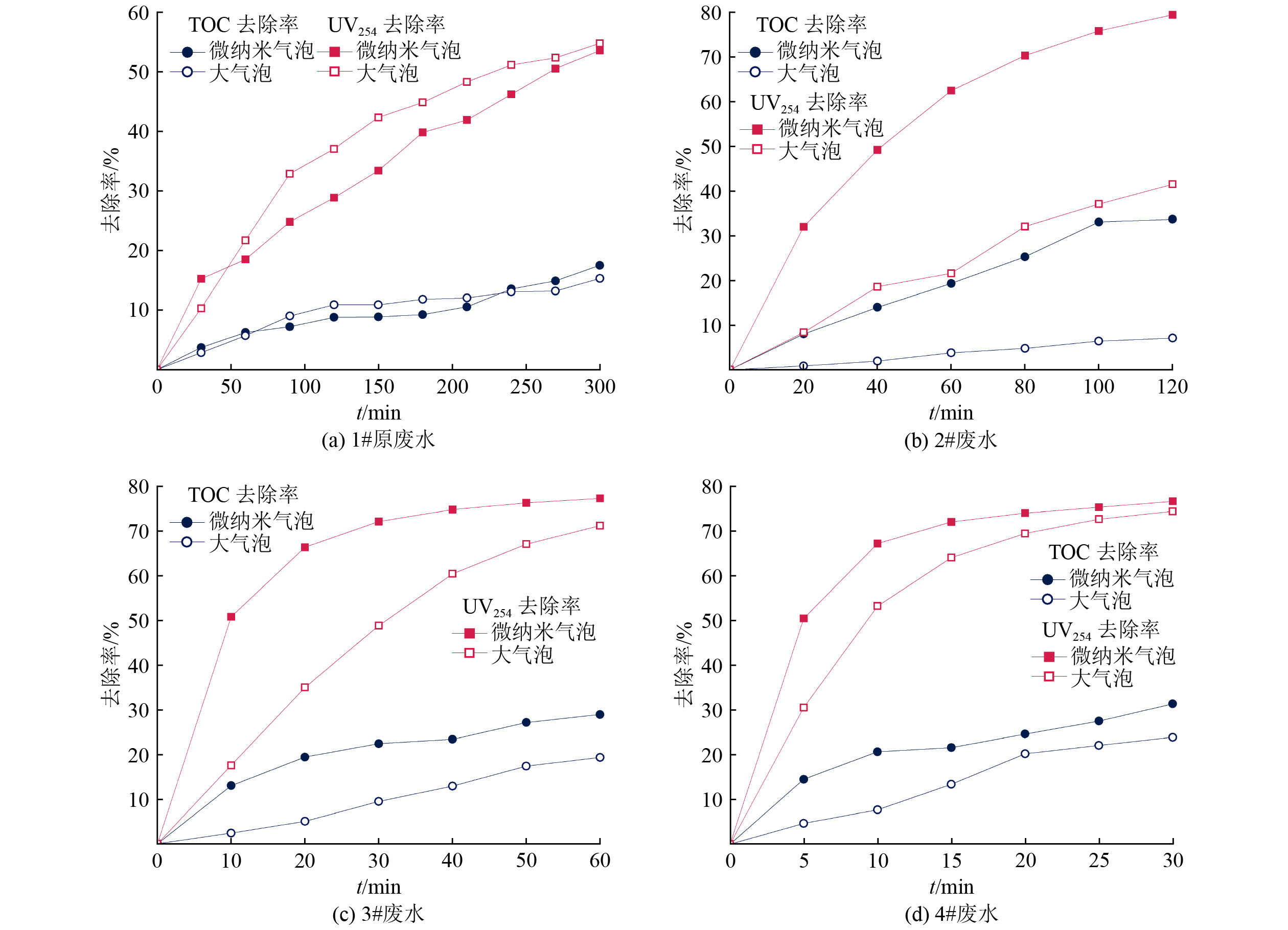
为了探究废水中盐离子、有机物浓度对微纳米气泡与大气泡处理效果的影响,分别使用MVR浓缩母液及稀释不同倍数的废水开展臭氧氧化试验,有机物降解效果采用TOC和UV254来表征,去除率变化如图4所示。由图4(a)可知,对于原MVR母液(1#原废水),经臭氧微纳米气泡、普通大气泡处理300 min后,TOC的去除率分别为17.50%和15.29%,UV254的去除率分别为53.55%和54.76%,去除效果相近。由图4(b)可知,2#废水经臭氧微纳米气泡、普通大气泡处理120 min后,TOC的去除率分别为33.68%和7.08%,UV254的去除率分别为79.43%和41.52%,微纳米气泡对TOC和UV254的去除率分别是普通大气泡的4.76和1.91倍。在图4(c)中,3#废水经臭氧微纳米气泡和普通大气泡处理60 min后,TOC的去除率分别为28.91%和19.30%,UV254的去除率分别为77.29%和71.20%,微纳米气泡对TOC和UV254的去除率分别比普通大气泡提高了0.50和0.09倍。由图4(d)可知,4#废水经臭氧微纳米气泡处理30 min后,TOC和UV254的去除率分别为31.38%和76.64%,而普通大气泡的去除率分别为23.91%和74.40%,微纳米气泡对TOC和UV254的去除率分别比普通大气泡提高了0.31和0.03倍。
臭氧微纳米气泡技术对废水的处理效果与废水中盐浓度以及有机物浓度密切相关。在TOC为57.2~587.6 mg/L、电导率为3.47~28.6 mS/cm的范围内,臭氧微纳米气泡较普通大气泡有优势,TOC去除率提升0.50~3.76倍;当TOC为587.6 mg/L,电导率为28.6 mS/cm时,应用臭氧微纳米气泡相较于普通大气泡优势最显著;而继续增加废水中盐浓度及有机物浓度至TOC为5626 mg/L、电导率为164.3 mS/cm时,微纳米气泡与普通大气泡的去除效果相近。这是由于在低盐条件下,臭氧微纳米气泡的kLa高于普通大气泡,传质优势得以体现,更有利于提升有机物的去除率;而在高盐条件下,尽管微纳米气泡的kLa高于普通大气泡,但是水中大量的Cl−和有机物竞争臭氧,抑制了臭氧与有机物的反应,削弱了传质优势,导致有机物的去除效率降低。
2.2.2 臭氧氧化效率评价
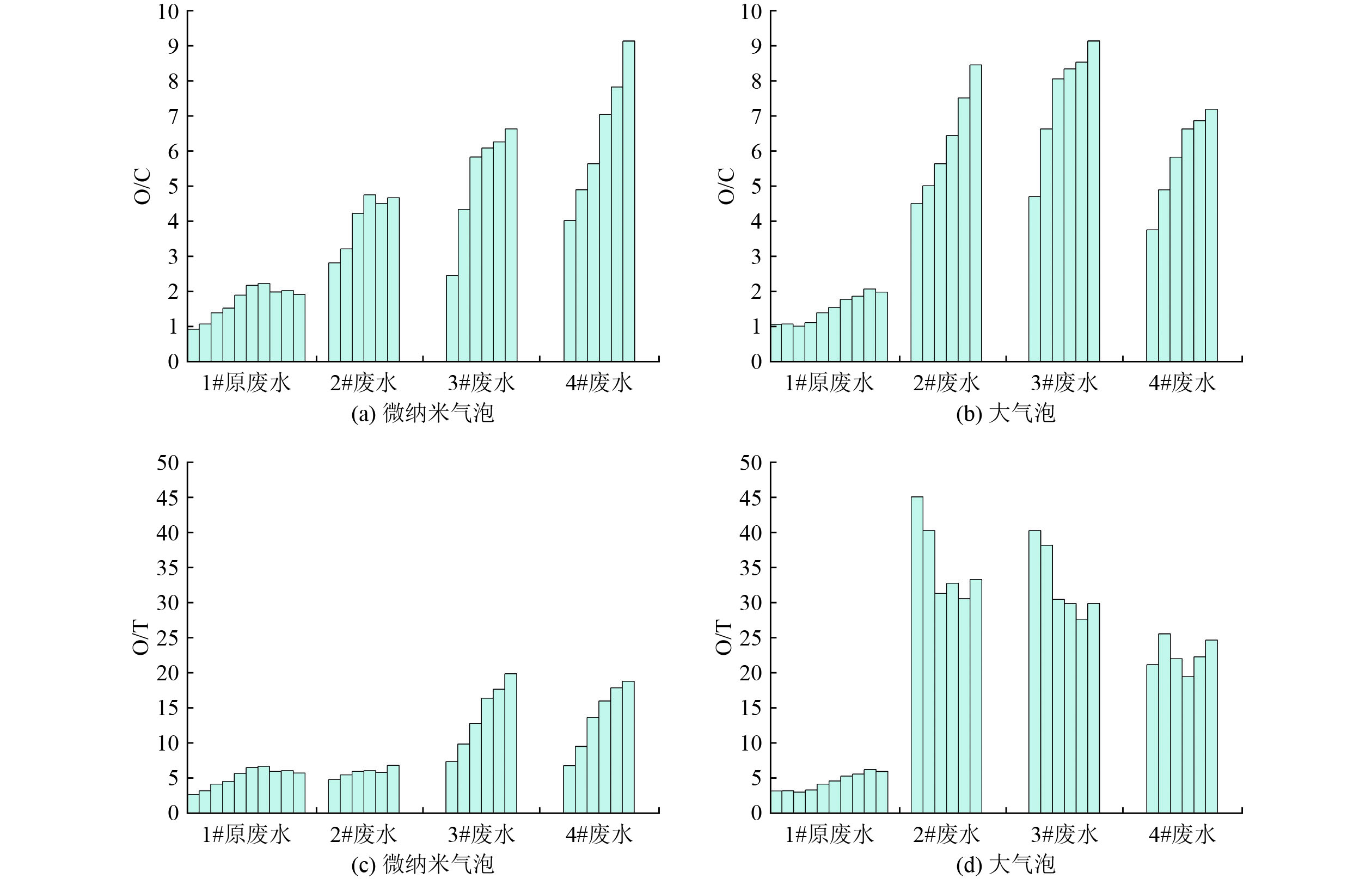
2种曝气方式对O/C与O/T的影响如图5所示。由图5(a)和(b)可知,随着废水中盐浓度及有机物浓度降低,微纳米气泡和普通大气泡的O/C均逐渐增加,这是由于臭氧氧化反应速率和有机物浓度呈正相关,有机物浓度越低,氧化反应速率越慢。
有机物浓度和盐浓度对于2种臭氧氧化技术的O/C差异影响显著。对于超高盐浓度和超高有机物浓度的1#原废水MVR母液 (COD为11 100 mg/L),微纳米气泡和普通大气泡反应结束后的O/C相近,均为2左右;对于高盐、高有机物的2#废水(COD为1 140 mg/L)和3#废水(COD为253 mg/L),微纳米气泡处理的O/C显著低于普通大气泡处理;对于低盐、低有机物的4#废水(COD为123 mg/L),普通大气泡处理O/C反而低于微纳米气泡(O/C为9.12)。
由图5(c)和(d)可知,臭氧微纳米气泡处理不同浓度废水的O/T均低于普通大气泡,2种臭氧处理的O/T变化规律差异显著,随着废水盐浓度及有机物浓度的升高,臭氧微纳米气泡处理的O/T由18.78逐渐降低到5.73;普通大气泡处理的O/T先从24.67增至33.25,然后急剧下降到与微纳米气泡处理相似的水平(5.94)。
废水中的盐离子对臭氧氧化过程同时存在促进和抑制两方面的影响:一方面盐离子影响气泡的尺寸从而影响臭氧的传质,盐浓度越高,普通大气泡曝气生成的气泡尺寸越小,越有利于臭氧传质,但是高盐反而会使微纳米气泡尺寸略微增大;另一方面高浓度的Cl−会淬灭臭氧和自由基,从而抑制臭氧氧化有机物反应。对比图5中2种臭氧氧化的O/C和O/T可以发现,在处理超高盐和超高有机物废水时,抑制作用抵消了微纳米气泡的传质促进作用,2种技术的处理效果基本一致,但是处理高盐高有机物废水时,微纳米气泡的传质促进作用显著大于抑制作用,从而降低了O/C和O/T。在处理低盐低有机物废水时,由于有机物浓度低,传质过程不再是整个臭氧氧化过程的控速步骤,微纳米气泡的传质优势无法体现。
2.3 臭氧处理过程中有机物表征分析
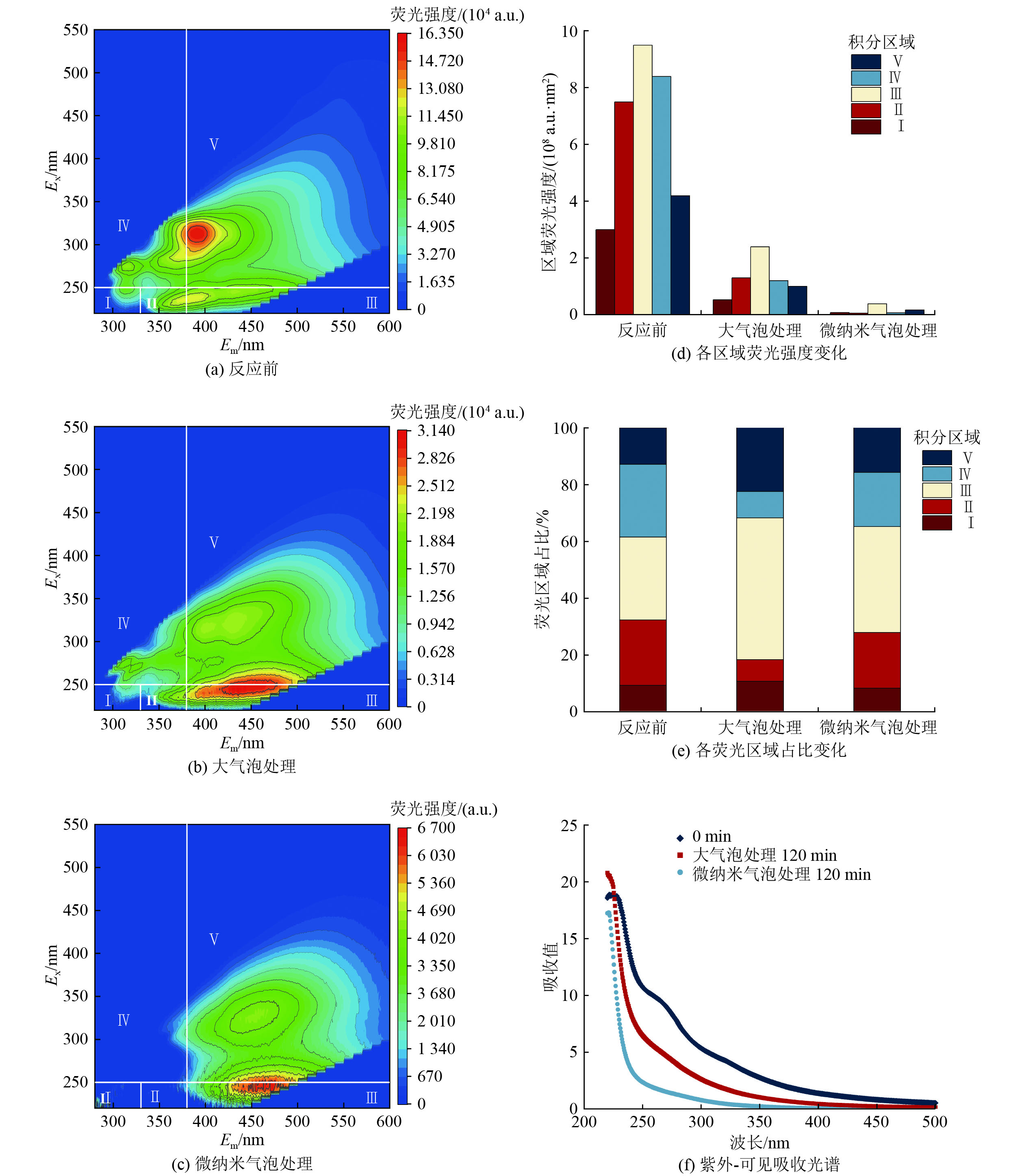
由于臭氧微纳米气泡与普通大气泡对2#废水(初始TOC浓度为587.6 mg/L,电导率为28.6 mS/cm)的去除效果差异最为明显,因此对处理前后的2#废水进行三维荧光及紫外-可见吸收光谱分析,结果如图6所示。参考已有文献[27],根据有机物类型将荧光相应区域分为Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ 5个荧光区域(表3)。
表 3 荧光积分区域划分范围Table 3. Scope of fluorescence integral area区域 有机物类型 激发波长(Ex)/nm 发射波长(Em)/nm Ⅰ 类酪氨酸 220~250 280~330 Ⅱ 类色氨酸 220~250 330~380 Ⅲ 类富里酸 220~250 380~550 Ⅳ 溶解性微生物产物 250~450 280~380 Ⅴ 类腐殖酸 250~450 380~550 由图6(a)~(c)可知,经过臭氧微纳米气泡和普通大气泡处理,区域Ⅴ的荧光强度显著降低,表明这2种处理方式均能高效去除MVR母液中的类腐殖酸组分。此外,图6(c)中区域Ⅰ、Ⅱ、Ⅳ的荧光强度也显著下降,表明臭氧微纳米气泡几乎能够完全去除类酪氨酸、类色氨酸以及溶解性微生物产物组分,而图6(b)的变化趋势不明显,说明普通大气泡对上述3种组分的去除效果不理想。同时,对5个荧光区域分别积分(FRI),得到各区域荧光强度和占比,见图6(d)和(e)。从图6(e)可以看出,区域Ⅲ反应前占比为29.2%,经臭氧微纳米气泡处理后占比为49.9%,经臭氧大气泡处理后占比为37.3%,说明焦化废水中的类富里酸组分更难被臭氧氧化。图6(f)为处理前后2#废水的紫外-可见吸收光谱,可以看出在波长250~300 nm范围内的吸光度下降较为明显,说明臭氧微纳米气泡及普通大气泡主要去除焦化废水中的多环芳烃类物质,且臭氧微纳米气泡的处理效果更优。
2.4 经济性评价
实际工程中,能耗直接影响到处理过程的成本和效率。为了进一步确定微纳米气泡在实际工程应用中的适用范围,对微纳米气泡和普通大气泡的吨水能耗进行计算,计算公式如下:
$$ E=\frac{({P}_{{\mathrm{O}}_{3}}+{P}_{\mathrm{M}\mathrm{N}\mathrm{B}\mathrm{s}}+{P}_{{\mathrm{O}}_{2}})\times t}{V} $$ (10) 式中:E为吨水能耗,kW·h/m3;V为水样体积,m3;t为反应时间,h;$ {P}_{{\mathrm{O}}_{3}} $、$ {{P}}_{\mathrm{M}\mathrm{N}\mathrm{B}\mathrm{s}} $、$ {P}_{{\mathrm{O}}_{2}} $分别为臭氧发生器功率、微纳米气泡发生器功率、折算氧气功率,kW。其中,$ {P}_{{\mathrm{O}}_{3}}= $臭氧投加量(kg)×7.5,7.5为以臭氧投加量换算臭氧发生器功率的经验系数,kW/kg;$ {{P}}_{\mathrm{M}\mathrm{N}\mathrm{B}\mathrm{s}} $=臭氧投加量(kg)×7.1,7.1为以臭氧投加量换算微纳米气泡发生器功率的经验系数,kW/kg;$ {{P}}_{{\mathrm{O}}_{2}} $根据产生1 kg臭氧气体所需要氧气的价格,以用电成本0.7元/(kW·h)折算为功率值,$ {{P}}_{{\mathrm{O}}_{2}} $=臭氧投加量(kg)×0.84,0.84为核算后经验系数,kW/kg。
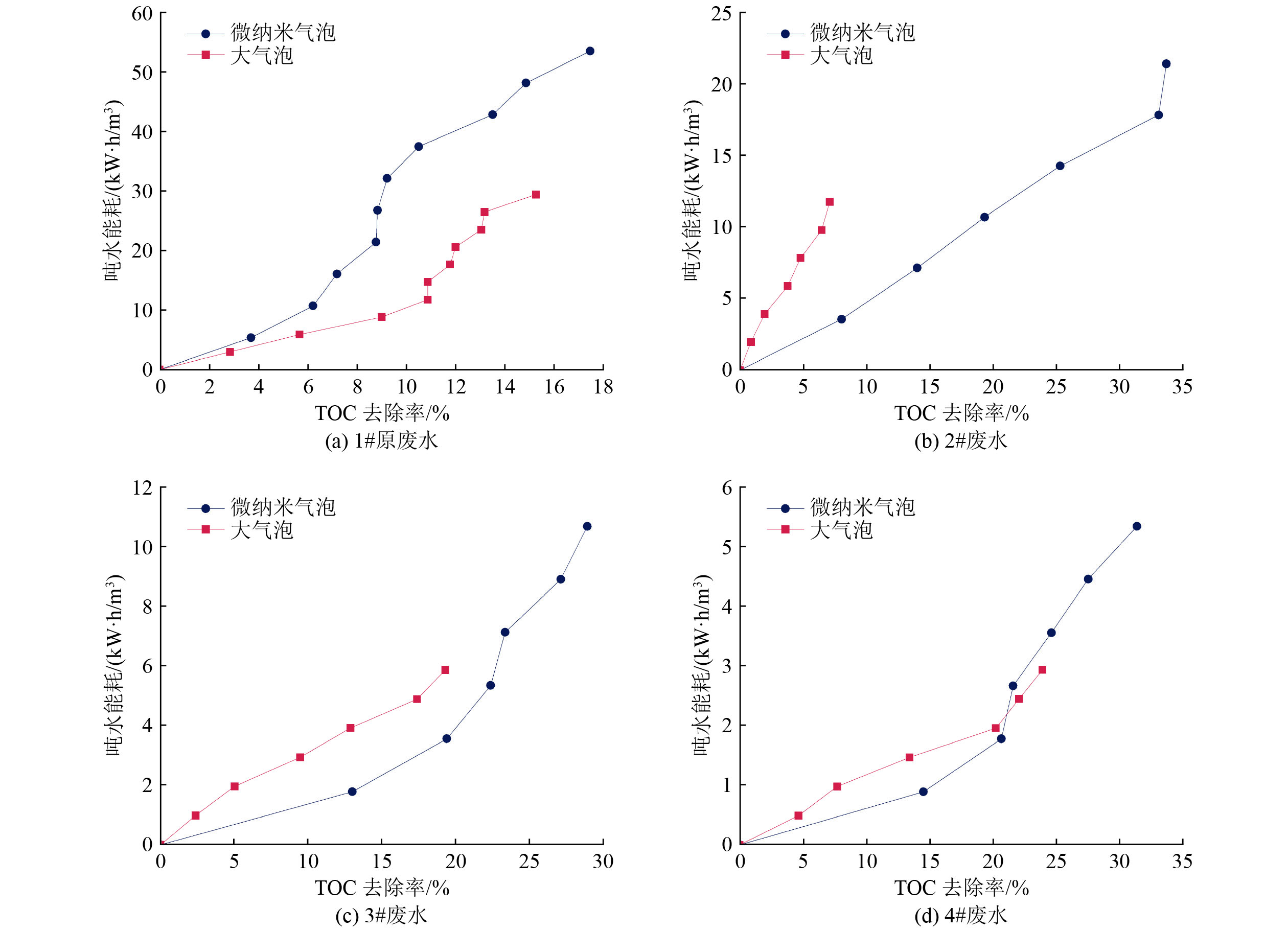
通过计算微纳米气泡和普通大气泡处理4种废水的吨水能耗,做出TOC去除率与吨水能耗的相关性曲线,如图7所示。由图7可知,在达到相同TOC去除率的条件下,采用臭氧微纳米气泡处理1#原废水的吨水能耗要明显高于臭氧大气泡处理时的吨水能耗。对于2#、3#及4#废水,在TOC去除率相同时,微纳米气泡处理时的吨水能耗要明显低于普通大气泡,尤其在2#废水(TOC浓度为587.6 mg/L,电导率为28.6 mS/cm)的条件下,臭氧微纳米气泡优势最为明显,当TOC去除率达到33%时,其能耗为17.82 kW·h/m3,相较之下,普通大气泡处理在TOC去除率为7%时的能耗已经达到11.75 kW·h/m3。因此,在较低的废水盐浓度及有机物浓度时,采用臭氧微纳米气泡处理会降低吨水能耗,但在高盐浓度和高有机物浓度条件下(例如初始TOC浓度为5 626 mg/L,电导率为164.3 mS/cm)采用臭氧微纳米气泡反而造成更大的吨水能耗,在此条件下选择臭氧大气泡处理会更加节约经济成本。
3. 结论
(1)在高盐条件下,微纳米气泡倾向于生成更大的气泡,气泡尺寸增加。臭氧微纳米气泡曝气的饱和液相臭氧浓度是普通大气泡曝气的1.3倍左右,二者的饱和液相臭氧浓度会随着盐度增加而减少。此外,臭氧传质系数及臭氧自分解速率随着盐浓度的升高而增加,微纳米气泡的增加幅度超过普通大气泡,盐浓度对臭氧微纳米气泡传质过程的影响更为显著。
(2)随着废水中盐及有机物浓度的升高,臭氧微纳米气泡相较于臭氧大气泡降解有机物的优势更加明显,当废水中TOC浓度为57.21~587.6 mg/L,电导率为3.47~28.6 mS/cm时,臭氧微纳米气泡较普通大气泡的TOC去除率提升0.50~3.76倍,O/C与O/T显著下降。然而,当TOC为5 626 mg/L,电导率为164.3 mS/cm时,微纳米气泡处理效果与普通大气泡趋于一致,二者的O/C与O/T相近。
(3)臭氧氧化处理MVR母液过程中,主要去除类腐殖酸组分和多环芳烃类物质,臭氧微纳米气泡几乎能够完全去除类酪氨酸、类色氨酸以及溶解性微生物产物组分,而臭氧大气泡对这3种组分的去除效果不佳。
(4)处理高盐、高有机物废水时,采用臭氧微纳米气泡可显著降低吨水能耗,当TOC浓度为587.6 mg/L,电导率为28.6 mS/cm时,TOC去除率为7%时的吨水能耗为3.4 kW·h/m3,比同样条件下的普通大气泡降低了71%。但处理超高盐、超高有机物浓度废水时(TOC为5626 mg/L,电导率为164.3 mS/cm),臭氧微纳米气泡的吨水能耗要高于普通大气泡。经济效益评价结果有待通过中试放大及生产试验进一步验证。
-
表 1 待处理废水的主要成分和指标
Table 1 Main components and indexes of wastewater to be treated
废水 稀释倍数 电导率/(mS/cm) pH COD/(mg/L) 总有机碳(TOC)/(mg/L) ${\mathrm{SO}}_4^{2-} $/(mg/L) Cl−/(mg/L) UV254 1#原废水 不稀释 164.30 9.34 11 100 5 626.0 149 220 74 310 0.870 2#废水 10倍 28.60 8.72 1 140 587.6 14 720 7 350 1.038 3#废水 50倍 6.44 7.45 253 117.7 2 941 1 437 1.030 4#废水 100倍 3.47 7.16 123 57.2 1 460 726 1.070 注:UV254为稀释后的测定值,1#原废水稀释100倍,2#废水稀释10倍,3#废水稀释2倍,4#废水不稀释。 表 2 盐浓度对不同臭氧曝气方式的气泡尺寸和传质参数的影响
Table 2 Impact of salt concentration on bubble size and mass transfer parameters by various ozone aeration methods
NaCl浓度/
(mol/L)曝气方式 D50 Cs/
(mg/L)kLa/min−1 kd/min−1 微米
气泡/μm纳米
气泡/nm0.1 大气泡 33.60 0.157 0.047 微纳米气泡 35.99 139.60 45.18 0.364 0.042 1 大气泡 23.46 0.171 0.112 微纳米气泡 102.11 197.50 29.20 0.413 0.130 表 3 荧光积分区域划分范围
Table 3 Scope of fluorescence integral area
区域 有机物类型 激发波长(Ex)/nm 发射波长(Em)/nm Ⅰ 类酪氨酸 220~250 280~330 Ⅱ 类色氨酸 220~250 330~380 Ⅲ 类富里酸 220~250 380~550 Ⅳ 溶解性微生物产物 250~450 280~380 Ⅴ 类腐殖酸 250~450 380~550 -
[1] TAMANG M, PAUL K K. Advances in treatment of coking wastewater: a state of art review[J]. Water Science and Technology,2022,85(1):449-473. DOI: 10.2166/wst.2021.497
[2] 钱易, 文一波, 张辉明. 焦化废水中难降解有机物去除的研究[J]. 环境科学研究,1992,5(5):1-9. DOI: 10.3321/j.issn:1001-6929.1992.05.001 QIAN Y, WEN Y B, ZHANG H M. A study on the refractory organics removal from coke-plant wastewater[J]. Research of Environmental Sciences,1992,5(5):1-9. DOI: 10.3321/j.issn:1001-6929.1992.05.001
[3] 张锐, 袁进, 李超. 焦化废水浓盐水零排放处理技术研究进展[J]. 工业水处理,2023,43(6):15-21. ZHANG R, YUAN J, LI C. Research progress on zero emission treatment technology for concentrated brine from coking wastewater[J]. Industrial Water Treatment,2023,43(6):15-21.
[4] 卜兆骏, 仇雅丽, 刘勇奇, 等. Ti/Ru-Ir电极电催化氧化法降解MVR浓缩母液的研究[J]. 广东化工,2023,50(6):67-69. DOI: 10.3969/j.issn.1007-1865.2023.06.021 BU Z J, QIU Y L, LIU Y Q, et al. Study on degradation of concentrated mother liquor of MVR by electrocatalytic oxidation with Ti/Ru-Ir electrode[J]. Guangdong Chemical Industry,2023,50(6):67-69. DOI: 10.3969/j.issn.1007-1865.2023.06.021
[5] 李妍. 臭氧催化氧化法在污水处理中的应用研究进展[J]. 中国资源综合利用,2020,38(12):122-124. DOI: 10.3969/j.issn.1008-9500.2020.12.038 LI Y. Application research progress of ozone catalytic oxidation method in wastewater treatment[J]. China Resources Comprehensive Utilization,2020,38(12):122-124. DOI: 10.3969/j.issn.1008-9500.2020.12.038
[6] 程莹, 臧纪, 宋骏杰, 等. 基于臭氧微纳米气泡的O3-H2O2体系降解有机污染物的效能与影响因素[J]. 环境工程技术学报,2022,12(4):1317-1323. CHENG Y, ZANG J, SONG J J, et al. Degradation efficiency and influencing factors of organic contaminants in O3-H2O2 system based on ozone micro-nanobubbles[J]. Journal of Environmental Engineering Technology,2022,12(4):1317-1323.
[7] TAKAHASHI M, CHIBA K, LI P. Free-radical generation from collapsing microbubbles in the absence of a dynamic stimulus[J]. The Journal of Physical Chemistry B,2007,111(6):1343-1347. DOI: 10.1021/jp0669254
[8] TEMESGEN T, BUI T T, HAN M, et al. Micro and nanobubble technologies as a new horizon for water-treatment techniques: a review[J]. Advances in Colloid and Interface Science,2017,246:40-51. DOI: 10.1016/j.cis.2017.06.011
[9] ZHANG L, LI P, WANG X L, et al. Promotion effect of foam formation on the degradation of polyvinyl alcohol by ozone microbubble[J]. Journal of Environmental Chemical Engineering,2023,11(6):111192. DOI: 10.1016/j.jece.2023.111192
[10] 马艳, 张鑫, 韩小蒙, 等. 臭氧微纳米气泡技术在水处理中的应用进展[J]. 净水技术,2019,38(8):64-67. MA Y, ZHANG X, HAN X M, et al. Application of micro-nano ozone bubble technology in water treatment: a review[J]. Water Purification Technology,2019,38(8):64-67.
[11] LIU C, CHEN X X, ZHANG J, et al. Advanced treatment of bio-treated coal chemical wastewater by a novel combination of microbubble catalytic ozonation and biological process[J]. Separation and Purification Technology,2018,197:295-301. DOI: 10.1016/j.seppur.2018.01.005
[12] CHU L B, XING X H, YU A F, et al. Enhanced treatment of practical textile wastewater by microbubble ozonation[J]. Process Safety and Environmental Protection,2008,86(5):389-393. DOI: 10.1016/j.psep.2008.02.005
[13] 张亮, 周姝岑, 李攀, 等. 电絮凝-微纳米气泡臭氧氧化工艺处理高盐印染废水的研究[J]. 环境工程技术学报,2023,13(2):639-647. ZHANG L, ZHOU S C, LI P, et al. Study on treatment of high-salt printing and dyeing wastewater by electroflocculation-micro-nano-bubble ozone oxidation process[J]. Journal of Environmental Engineering Technology,2023,13(2):639-647.
[14] 冯玥, 王璐, 陈泉源. 臭氧微气泡深度处理染料废水生化出水[J]. 环境工程学报,2013,7(12):4653-4658. FENG Y, WANG L, CHEN Q Y. Ozone microbubbles in tertiary purification of biological treatment effluent of dye-making wastewater[J]. Chinese Journal of Environmental Engineering,2013,7(12):4653-4658.
[15] 张静, 张守敬, 刘春, 等. 工业废水水质对微气泡臭氧化深度处理影响[J]. 环境科学,2020,41(4):1752-1760. ZHANG J, ZHANG S J, LIU C, et al. Influence of industrial wastewater quality on advanced treatment of microbubble ozonation[J]. Environmental Science,2020,41(4):1752-1760.
[16] 周姝岑, 芦婉蒙, 李攀. 微纳米气泡臭氧氧化处理印染废水产生的RO浓水[J]. 中国给水排水,2022,38(9):88-93. ZHOU S C, LU W M, LI P. Micro-nanobubble ozone oxidation for the treatment of RO concentrated water from dyeing wastewater[J]. China Water & Wastewater,2022,38(9):88-93.
[17] 张培龙, 于丽, 庞立飞, 等. 微气泡曝气O3/H2O2处理RO浓水的效能及影响因素[J]. 环境工程学报,2014,8(1):242-248. ZHANG P L, YU L, PANG L F, et al. Treatment efficiency and influencing factors of RO concentrated water by microbubble ozonation with H2O2[J]. Chinese Journal of Environmental Engineering,2014,8(1):242-248.
[18] 张全忠, 吴潘, 梁斌, 等. 液相中臭氧浓度的检测[J]. 工业水处理,2001,21(4):30-32. ZHANG Q Z, WU P, LIANG B, et al. Determination of the concentration of ozone in liquid phase[J]. Industrial Water Treatment,2001,21(4):30-32.
[19] BADER H, HOIGNÉ J. Determination of ozone in water by the indigo method[J]. Water Research,1981,15(4):449-456. DOI: 10.1016/0043-1354(81)90054-3
[20] ROUSTAN M, WANG R Y, WOLBERT D. Modeling hydrodynamics and mass transfer parameters in a continuous ozone bubble column[J]. Ozone: Science & Engineering, 1996, 18(2): 99-115.
[21] JIANG P, CHEN H T, BABCOCK R W Jr, et al. Modeling ozone mass transfer in reclaimed wastewater[J]. Water Environment Research: a Research Publication of the Water Environment Federation,2009,81(1):57-68. DOI: 10.2175/106143008X325782
[22] 国家环境保护总局.水质 化学需氧量的测定 快速消解分光光度法: HJ/T 399—2007[S/OL] 2024-01-05]. https://www.doc88.com/p-1045433167286.html.
[23] LU K C, REN T F, YAN N, et al. Revisit the role of salinity in heterogeneous catalytic ozonation: the trade-off between reaction inhibition and mass transfer enhancement[J]. Environmental Science & Technology,2023,57(47):18888-18897.
[24] BONCZ M A, BRUNING H, RULKENS W H, et al. The effect of salts on ozone oxidation processes[J]. Ozone: Science & Engineering, 2005, 27(4): 287-292.
[25] WANG J L, WANG S Z. Effect of inorganic anions on the performance of advanced oxidation processes for degradation of organic contaminants[J]. Chemical Engineering Journal,2021,411:128392. DOI: 10.1016/j.cej.2020.128392
[26] LEVANOV A V, ISAIKINA O Y. Mechanism and kinetic model of Chlorate and perchlorate formation during ozonation of aqueous chloride solutions[J]. Industrial & Engineering Chemistry Research,2020,59(32):14278-14287.
[27] CHEN W, WESTERHOFF P, LEENHEER J A, et al. Fluorescence excitation-emission matrix regional integration to quantify spectra for dissolved organic matter[J]. Environmental Science & Technology,2003,37(24):5701-5710. ◇
-
期刊类型引用(1)
1. 司光祯,朱兴海. 基于微纳米气泡修复技术的重金属水处理及净化性能研究. 生态与资源. 2024(10): 101-103 .  百度学术
百度学术
其他类型引用(0)



 下载:
下载: